Cục Quản lý Dược (Bộ Y tế) vừa ban hành văn bản gửi Sở Y tế TP Hồ Chí Minh và Công ty TNHH DKSH Pharma Việt Nam về việc xác minh, xử lý thông tin liên quan đến thuốc Lexomil ® 6mg có dấu hiệu giả mạo.
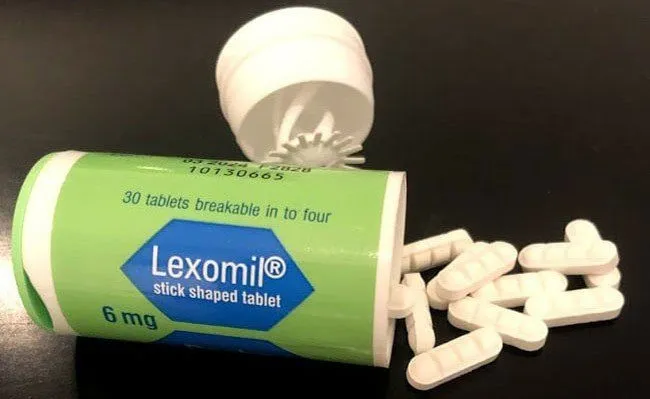
Trước đó, Cục Quản lý Dược nhận được công văn số 01-Aug-2025 của Công ty TNHH DKSH Pharma Việt Nam, kèm báo cáo ngày 20/8/2025 của Cheplapharm Arzneimottel GmbH (Đức).
Theo nội dung báo cáo, Công ty DKSH Pharma Việt Nam hiện là đơn vị nhập khẩu một số sản phẩm thuốc do Cheplapharm Arzneimottel GmbH sở hữu. Sản phẩm Lexomil ® 6mg, số lô F3193F01, hạn dùng 12/2027, đóng gói hộp 30 viên, được sản xuất tại Pháp vào ngày 7/12/2022 và phân phối tại thị trường Pháp. Sản phẩm này không được DKSH Pharma Việt Nam nhập khẩu và không phân phối tại Việt Nam.
Kết quả đối chiếu giữa mẫu thuốc thật và sản phẩm do Công an TP.HCM thu giữ cho thấy lô Lexomil ® 6mg nêu trên là thuốc giả. Đồng thời, tra cứu trên hệ thống Dịch vụ công của Cục Quản lý Dược cũng cho thấy chưa có thuốc nào có tên Lexomil ® 6mg được cấp số đăng ký lưu hành tại Việt Nam.
Nhằm đảm bảo an toàn cho người dân, Cục Quản lý Dược yêu cầu Sở Y tế TP Hồ Chí Minh khẩn trương phối hợp với các cơ quan chức năng liên quan để kiểm tra, giám sát, xác minh và truy tìm nguồn gốc lô thuốc giả, đồng thời báo cáo kết quả về Cục trước ngày 25/9/2025.
Cục Quản lý Dược cũng yêu cầu Sở Y tế TP Hồ Chí Minh thông báo rộng rãi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn về việc không buôn bán, sử dụng sản phẩm này; các đơn vị liên quan cần tiếp tục triển khai nghiêm chỉ đạo của Thủ tướng Chính phủ về tăng cường công tác chống buôn lậu, gian lận thương mại và hàng giả trong tình hình mới.
Cục Quản lý Dược cũng đề nghị Công ty TNHH DKSH Pharma Việt Nam cung cấp thông tin đầy đủ, chính xác và phối hợp với Sở Y tế TP Hồ Chí Minh và các cơ quan hữu quan trong việc truy tìm nguồn gốc của lô thuốc Lexomil ® 6mg nghi ngờ giả nêu trên.